 Os Dragões-marinhos são encontrado somente em águas sul-australianas. Estes peixes espetaculares pertencem à família Syngnathidae, a mesma do Cavalo-marinho.
Os Dragões-marinhos são encontrado somente em águas sul-australianas. Estes peixes espetaculares pertencem à família Syngnathidae, a mesma do Cavalo-marinho.As duas espécies de dragão-marinho, o dragão-marinho (Phycodurus eques) e o dragão-marinho comum (Phyllopteryx taeniolatus), possuem muitos apêndices em forma de folhas em suas cabeças e corpos. A semelhança dos dragões-marinhos com os cavalos-marinhos é superficial, porque as duas espécies de dragões-marinhos, são mais próximos relacionadas aos peixes-cachimbo (Gomon et al. 1994).
Phyllopteryx taeniolatus
Possuem aproximadamente 46 cm de comprimento. Os adultos são geralmente avermelhados com pontos amarelos e barras roxo-azuladas pelo corpo. Os apêndices em forma de folha, ocorrem aos pares ao longo do corpo. Também possuem alguns espinhos curtos ao longo do corpo.
Phyllopteryx taeniolatus
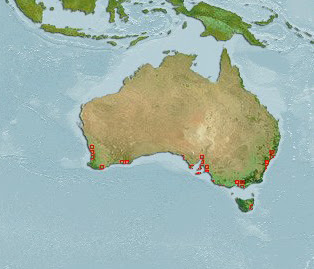
A diferença sexual é bem visível, os machos possuem os corpo mais esbelto com cores mais escuras que a fêmea. São encontrados na Austrália ocidental ao longo da costa sul australiana, incluindo a Tasmânia.
Hábitat natural de Phyllopteryx taeniolatus
Dragão-marinho (Phycodurus eques)
Phycodurus eques
São ligeiramente menores, possuem cerca de 43cm, porém a maioria alcançam uma média de 30cm. Seus apêndices em forma de folha são mais numerosos e ramificados . Os adultos são amarelo-marrom esverdeados, com as faixas escuras, finas e pálidas.
Phycodurus eques
Assim como os cavalos-marinhos, os dragões-marinhos também podem mudar de cor dependendo da idade, da dieta, da posição ou mesmo do seu nível do stress. Ao contrário do dragão-marinho comum, seus olhos são posicionados ligeiramente acima do túbulo bucal. Possuem diversos espinhos afiados longos em todos os lados do corpo. Os mesmos são usados para defesa contra o ataque de peixes. Recentes pesquisas mostram que o dragão-marinho (Phycodurus eques) possue um sistema de navegação altamente sofisticado, mergulhando a centenas de metros e voltando sempre ao mesmo local que normalmente vive (Connolly 1998).
São encontrados na Austrália ocidental ao longo da costa sul australiana, nas regiões próximas a Wilsons e Victoria.
São encontrados na Austrália ocidental ao longo da costa sul australiana, nas regiões próximas a Wilsons e Victoria.
Hábitat natural de Phycodurus eques
O balanço das Algas marinhas
Phycodurus eques
Os dragões-marinhos assemelham-se ao movimento das algas marinha, o que os torna difíceis de encontrar em seus habitats naturais. Com seus movimentos lentos e sua capacidade incrível de se camuflar em meio as algas, conseguem garantir sua sobrevivência. Suas cores brilhantes são reveladas na luz do sol que penetra na água.
Algas marinhas
Ambas as espécies de dragões-marinhos habitam os recifes de corais e as estruturas colonizadas pelas algas marinhas. No ambiente selvagem vivem individualmente ou em pares, sendo vistos mais freqüentemente em águas litorâneas rasas. Alimentam sugando com suas pequenas boca; plankton, peixes e pequenas larvas de crustáceos em geral.
Reprodução
No período reprodutivo, os machos e fêmeas emparelham-se. A fêmea desenvolve cerca de 300 ovos alaranjados em sua cavidade abdominal mais baixa. A metade final da cauda do macho começa a formar pequenos "copos de ovos" na cauda, os quais armazenarão os ovos que a fêmea irá transferir para o macho e conseqüentemente serão fertilizados.
O macho carrega os ovos por um período de incubação de aproximadamente 4 semanas. Ao nascerem, os dragões-marinhos medem aproximadamente 20mm e possuem um colorido diferente dos adultos. Os jovens são predados por peixes, crustáceos e anêmonas do mar; vivendo em lugares diferentes dos adultos.
O macho carrega os ovos por um período de incubação de aproximadamente 4 semanas. Ao nascerem, os dragões-marinhos medem aproximadamente 20mm e possuem um colorido diferente dos adultos. Os jovens são predados por peixes, crustáceos e anêmonas do mar; vivendo em lugares diferentes dos adultos.
Reprodução de Phycodurus eques
Possuem crescimento rápido, alcançando 20cm após um ano e tornando-se sexualmente maduros após aproximadamente dois anos.
Em ambiente natural não é conhecida sua média de vida, e em cativeiro vivem aproximadamente de 5 a 7 anos.
Em ambiente natural não é conhecida sua média de vida, e em cativeiro vivem aproximadamente de 5 a 7 anos.
Phycodurus eques
Referências Bibliográficas
Adaptado e traduzido por Ricardo Britzke
© Copyright 2007 ©
© Copyright 2007 ©








 13:28
13:28
 NaturePlanet
NaturePlanet


























 Corydoras ortegai é assinalada a um possível grupamento monofilético de Corydoras que ocorrem principalmente na bacia amazônica ocidental, exceto Corydoras tukano. A ocorrência de Corydoras tukano no rio Tiquié (alto curso da bacia do rio Negro) e sua possível espécie irmã, Corydoras ortegai, na Amazônia ocidental, associada a um padrão de distribuição semelhante compartilhado por outros grupos de peixes, sugerem uma relação biogeográfica entre estas áreas.
Corydoras ortegai é assinalada a um possível grupamento monofilético de Corydoras que ocorrem principalmente na bacia amazônica ocidental, exceto Corydoras tukano. A ocorrência de Corydoras tukano no rio Tiquié (alto curso da bacia do rio Negro) e sua possível espécie irmã, Corydoras ortegai, na Amazônia ocidental, associada a um padrão de distribuição semelhante compartilhado por outros grupos de peixes, sugerem uma relação biogeográfica entre estas áreas.

































